Reproducción vegetal
En botánica, la reproducción vegetal designa a los variados mecanismos a través de los cuales las plantas se multiplican.
Los musgos, los helechos y las plantas superiores muestran una increíble diversidad de Historias de vida, hábito de crecimiento y fisiologías. En todos estos vegetales coexisten tanto la reproducción sexual como la asexual. La gran mayoría producen esporas como medio para asegurar la dispersión de cada especie y su supervivencia en condiciones.
Así pues, las esporas son la unidad reproductiva y de dispersión de algunas plantas y contienen toda la información genética necesaria para el desarrollo de un nuevo individuo.
Dichas esporas pueden formarse tanto sexual como asexualmente y en estructuras sumamente diversas.
La reproducción sexual puede involucrar a un solo individuo o a dos de ellos. En este último caso, ambos individuos deben pertenecer a sexos o tipos de apareamiento diferentes.
En algunos grupos de plantas solo hay dos tipos de apareamiento, mientras que en otros existen miles. En algunos helechos, los gametófitos haploides individuales producen tanto óvulos como espermatozoides. En otros, los gametófitos individuales producen solo un tipo de gameto. En las plantas con semilla, las estructuras productoras de polen y de óvulos pueden crecer juntas dentro de una misma flor, desarrollarse por separado en diferentes flores de la misma planta o bien, ser producidas en plantas completamente diferentes.
En ambos grupos de plantas, pteridofitas y plantas con semillas, estos patrones diferentes de distribución de las estructuras que forman los gametos femeninos y masculinos influye sobre la frecuencia con la que los gametos de individuos no relacionados se unen en cigotos. A su vez, este proceso influencia la cantidad y distribución de la diversidad genética.
Alternancia de generaciones y de fases nucleares[editar]
Es característico del ciclo vital de la mayoría de las plantas una alternancia de generaciones. En los casos típicos se trata de la alternancia regular de dos generaciones celulares que difieren entre sí por su modo de reproducción. Estas generaciones están representadas por individuos independientes, a menudo muy distintos entre sí desde el punto de vista de su morfología. En general, la alternancia de generaciones va unida a una alternancia de fases nucleares simultánea, o sea, a cambios en el número de juegos de cromosomas.
La alternación de generaciones y de fases nucleares puede ser ejemplificada con el ciclo de vida de un helecho. La planta foliosa que se observa, el «helecho», es un esporófito diploide —presenta dos juegos de cromosomas, lo cual se denota como «2n»— que por meiosis produce meiosporas haploides —tienen un solo juego de cromosomas, «n»—. Estas esporas germinan pero no producen un nuevo helecho folioso, sino un pequeño cuerpo taloso, haploide, que se denomina protalo. En esta estructura se formaran mediante mitosis los gametos haploides por lo que constituye el gametofito. La unión de dos gametos diferentes restablece el número cromosómico 2n y determina la formación de una nueva generación esporofítica. El gametófito haploide, productor de gametos, alterna entonces de modo regular con el esporófito diploide que se reproduce por meiosporas. Las células germinales de una generación producen con regularidad la otra generación.
Reproducción sexual[editar]
Meiosporas[editar]
Las meiosporas son las células (n) formadas a partir de la meiosis.
- Microesporas: son las que se producen en los órganos masculinos tras su maduración formaran los granos de polen. Cada grano de polen contiene una célula con dos núcleos (n): núcleo generativo y núcleo vegetativo. Durante la fecundación el núcleo vegetativo forma por mitosis el tubo polínico que crea un camino directo al ovario. Mientras esto ocurre, el núcleo generativo se divide por mitosis en dos anterozoides, que son los gametos masculinos.
- Megaesporas: Son las predecesoras de los gametos femeninos. Los óvulos no madurados situados en el ovario (2n) realizan la meiosis para formar las megaesporas(n) que tras su maduración formaran los sacos embrionarios, que son los gametófitos femeninos. Dentro del saco embrionario se encuentran 6 células (n), entre ellas estará la oósfera (gameto femenino). Aparte en el saco embrionario se encuentran dos núcleos polares. La oósfera es fecundada por un anterozoide para formar un embrión y un núcleo polar es fecundado por el otro anterozoide para dar lugar al endoesperma (tejido de reserva energética). El otro núcleo polar muere.
Gametos[editar]
Células reproductoras de algunos seres vivos.
Cigotos[editar]
El cigoto se forma después de la fecundación y su imagen o dureza sería la de un huevo.
Reproducción sexual en distintos grupos de plantas y hongos[editar]
Hongos[editar]

La gran mayoría de los hongos producen esporas como medio para asegurar la dispersión de la especie y su supervivencia en condiciones ambientales extremas. Así pues, las esporas son la unidad reproductiva y de dispersión de los hongos y contienen toda la información genética necesaria para el desarrollo de un nuevo individuo. En los hongos hay dos formas de reproducción: sexual y asexual, aunque en algunas especies coexisten ambas formas en el mismo organismo («holomorfo»), denominándose estado perfecto o «teleomorfo» a la forma sexual y estado imperfecto o «anamorfo» a la asexual. Así, los hongos que presentan reproducción sexual se denominan hongos perfectos y los que solo tienen, o solo se les conoce, reproducción asexual se denominan hongos imperfectos.

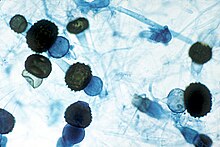
Las esporas sexuales de los hongos son más resistentes al calor que las asexuales, suelen presentar latencia, germinando solo cuando son activadas, por ejemplo por calor suave o alguna sustancia química. En la formación de las esporas sexuales intervienen una gran variedad de estructuras y, además, la reproducción sexual difiere notablemente entre los diversos grupos de hongos. Así, en los zigomicetes es por medio de unas hifas especializadas llamadas gametangios, en los ascomicetes se producen a través de unas células con aspecto de saco denominadas asco y en los basidiomicetes intervienen células especializadas denominadas basidios.[1]
En líneas generales dos núcleos haploides de dos células o gametos se unen formando una célula diploide que por meiosis da lugar a cuatro núcleos haploides. En este proceso suele haber recombinación genética. Si los hongos poseen en el mismo micelio núcleos complementarios capaces de conjugarse se llaman hongos «homotálicos » y si necesitan núcleos procedentes de micelios diferentes se llaman hongos «heterotálicos».
En los ascomicetes, normalmente las ascas contienen ocho ascosporas, producidas por una división celular meiótica seguida, en la mayoría de las especies, por una mitosis. Sin embargo, en algunos géneros o especies pueden contener una (por ejemplo, en Monosporascus cannonballus), dos, cuatro, u otro número múltiplo de cuatro. En algunos casos, las ascosporas pueden producir conidios, que pueden llenar por cientos las ascas (como en el género Tympanis), o pueden fragmentarse (como en algunos Cordyceps), llenando también las ascas de células más pequeñas. Las ascosporas son inmóviles y, por lo general, unicelulares, aunque no pocas veces pueden presentarseseptadas en uno o varios planos.
Usualmente, el micelio haploide de los basidiomicetes se fusiona a través de plasmogamia y luego los núcleos compatibles migran hacia el micelio del otro individuo de modo tal que se forma un dicarionte o micelio dicariótico, es decir un micelio que presenta dos núcleos diferentes. Por el contrario, el micelio que presenta un solo núcleo haploide se denomina monocarionte. La fusión de los dos núcleos en el dicarionte puede tardar desde semanas hasta años. Estacional u ocasionalmente los dicariontes producen basidios, células especializadas en las que los núcleos haploides compatibles se fusionan para formar núcleos diploides. Inmediatamente, estos núcleos sufren meiosis para producir cuatro núcleos haploides que migran cada uno hacia su propia basidiospora externa. En la mayoría de los basidiomicetes, estas esporas luego se dispersan para formar nuevos micelios haploides.
- Tipos de apareamiento
Los tipos de apareamiento son mecanismos que regulan la compatibilidad en los cruzamientos entre los hongos que se reproducen sexualmente. Debido a que los gametos en estos organismos no difieren en su tamaño, no se refieren como pertenecientes a sexos diferentes. Así, en vez de femenino o masculino, los tipos de apareamiento se designan con números, letras o simplemente con los signos "+" y "-". La fusión entre gametos o singamia solo puede ocurrir entre los que presenten diferente tipo de apareamiento. Los ascomicete en general presentan solo dos tipos de apareamiento. Los basidiomicetes, en cambio, pueden tener miles de tipos de apareamiento distintos.[2]
Musgos[editar]


Al igual que en el caso de los hongos, los musgos poseen un único conjunto de cromosomas, por lo que transcurren la mayor parte de su ciclo de vida como gametófitos haploides. Existen períodos durante el ciclo de vida del musgo cuando poseen un conjunto completo de cromosomas apareados pero esto solo ocurre durante la etapa de esporófito.[3][4]
Las esporas haploides germinan formando un protonema, que es o bien una masa de filamentos o un talloide plano. Del protonema crece el gametófito ("portador de gametos") que se diferencia en caulidios y filidos ('micrófilos'). De los extremos de los caulidios o ramas se desarrollan los órganos sexuales de los musgos. Los órganos femeninos se denominan arquegonios y los masculinos anteridios. El arquegonio posee un cuello por el cual se desliza el gameto masculino.
Los musgos pueden ser dioicos o monoicos. En el caso de musgos dioicos, los órganos sexuales masculinos y femeninos son portados por diferentes plantas gametofitas. En musgos monoicos (también llamados autoicos), existen en la misma planta. El esperma de los musgos es biflagelado, es decir posee dos flagelos que le ayudan en su propulsión. Sin agua, la fecundación no puede producirse. En presencia de agua, el gameto masculino nada desde el anteridio hasta la arquegonio y tiene lugar la fecundación, que da como resultado la producción de un esporófito diploide. Luego de la fecundación, el esporófito inmaduro se desplaza a través del conducto del arquegonio. La maduración del esporófito toma aproximadamente entre tres y seis meses. El cuerpo del esporófito comprende un largo pedúnculo, llamado seta, y una cápsula coronada por una cubierta llamada el opérculo. La cápsula y el opérculo se encuentran a su vez protegidos por una caliptra haploide que son los restos del conducto del arquegonio. La caliptra por lo general se desprende cuando la cápsula alcanza la madurez. Dentro de la cápsula, las células productoras de esporas sufren meiosis para formar esporas haploides, a partir de las cuales el ciclo se repite.
Helechos[editar]

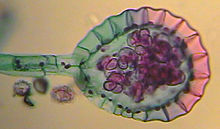

A diferencia de los hongos y de los musgos, la generación más conspicua de los helechos es el esporófito diploide. En los frondes aparecen los esporangios dentro de los cuales ocurre la meiosis formándose las esporas haploides, las cuales inician la generación gametofítica. Los esporangios pueden estar dispersos o agrupados en soros. Las esporas se nutren de los tejidos internos a la pared del esporangio, formando una cavidad en el esporangio a medida que el tejido nutricio se agota y las esporas maduran. Cuando la pared del esporangio se rompe las esporas se liberan y son dispersadas por el viento y donde caen se desarrolla el gametófito, el gametófito debe estar ligado al suelo para que ocurra la fecundación, ya que ésta depende del agua. El gametófito de las pteridofitas se denomina "protalo", normalmente es un talo pequeño, menor a un cm de diámetro, que absorbe agua por todo el cuerpo pero especialmente por rizoides. El gametófito de las pteridofitas es de vida libre ya que no depende del esporófito para su nutrición y crecimiento, generalmente es autótrofo. En el gametófito se desarrollan las estructuras reproductoras multicelulares: arquegonios que darán los gametos femeninos inmóviles, y los anteridios que producirán gametos masculinos móviles flagelados llamados anterozoides. Los anteridios aparecen en la parte posterior del protalo, entre los rizoides, en los grupos primitivos están inmersos en el protalo y su pared no está diferenciada del resto del tejido excepto en la superficie, formando en su interior un elevado número de espermatozoides; en los grupos más recientes los anteridios toman la forma de pequeñas esferas compuestas por una pared dentro de la cual se forman las células espermatógenas que darán 16 o 32 espermatozoides. Los anteridios poseen una célula llamada célula opercular, que es la que cede liberando los espermatozoides al exterior. Los arquegonios aparecen en la cara superior del gametófito, cerca de la escotadura, se forman a partir de una célula superficial que al dividirse va formando el cuello (única parte visible), el vaso y dentro de él la ovocélula y varias células más que degeneran formando una masa mucilaginosa. El mucílago atrae a los espermatozoides por quimiotaxis. Cuando el oocito se fecunda, se formará el cigoto que por sucesivas divisiones mitóticas nutrido por el gametófito femenino, dará el embrión primitivo. El embrión se sigue desarrollando hasta adulto sin entrar en latencia.
Angiospermas[editar]
La sexualidad de las plantas comprende la alternancia cíclica entre los estados de esporófito (la planta misma, diploide) y de gametófito (el grano de polen y el saco embrionario, ambos haploides). La meiosis que ocurre en las flores posibilita la recombinación y reducción del número de cromosomas y da lugar a la formación de las esporas está formado por 8 núcleos haploides y siete células, a saber: la ovocélula u oósfera, dos sinérgidas, una célula central binucleada, y tres antípodas. Por otra parte, las micrósporas desarrollan los granos de polen mediante un proceso de microgametogénesis. El polen maduro está típicamente integrado por tres células haploides (n), dos de las cuales constituyen los gametos masculinos o núcelos generativos. La otra, denominada célula vegetativa, tiene una función relacionada con el crecimiento del tubo polínico.
La formación de la semilla en las plantas sexuales involucra el proceso de doble fecundación único en las angiospermas: un gameto masculino (n) se fusiona con la ovocélula (n) para originar al cigoto (2n). A partir de este cigoto se desarrolla el embrión. La célula central del saco embrionario con sus dos núcleos polares (n + n) se fusiona con el otro núcleo generativo del grano de polen para originar el endosperma. La fusión de dos gametos haploides únicos derivados de la distribución al azar del material genético durante las meiosis masculina y femenina resulta en la generación de progenies genéticamente diversas. En resumen, en la reproducción sexual la meiosis y la fecundación producen la recombinación génica de los caracteres de ambos progenitores y, por lo tanto, son procesos creadores de nueva variabilidad genética.
Alogamia[editar]


La alogamia es un tipo de reproducción sexual en plantas consistente en la polinización cruzada y fecundación entre individuos genéticamente diferentes.[5] Este tipo de reproducción favorece la producción de individuos genéticamente nuevos y, por ende, la generación constante de variabilidad genética en las poblaciones. Existen mecanismos que impiden o reducen la autogamia en las angiospermas, tales como la autoincompatibilidad, la heterostilia, la hercogamia y la dioecia. Por otro lado, existen mecanismos que favorecen la transferencia del polen de una planta a los pistilos de otras plantas, a través de la polinización.
Polinización cruzada[editar]
La polinización es el proceso de transferencia del polen desde los estambres hasta el estigma o parte receptiva de las flores en las angiospermas, donde germina y fecunda los óvulos de la flor, haciendo posible la producción de semillas y frutos.[6]
El transporte del polen lo pueden realizar agentes físicos como el viento (plantas anemófilas), el agua (especies hidrófilas), o un polinizador animal (plantas zoófilas). Las características físicas y fenológicas de las flores anemófilas, hidrófilas y zoófilas, así como las de su polen, suelen ser marcadamente diferentes. Las plantas zoófilas deben llamar la atención de sus vectores con colores y olores atrayentes, así como recompensarlos con alimento o refugio. Diferentes tipos de polinizadores requieren diferentes tipos de atractivos, así las flores zoófilas han evolucionado y se han diversificado en una gran variedad de tipos los cuales pueden agruparse en síndromes florales. La belleza visual característicamente asociada a las flores es el efecto de su coevolución con insectos u otros animales polinizadores.
En los casos en que la polinización se produce como resultado de relaciones planta-animal estas relaciones son predominantemente de tipo mutualista. Es decir relaciones en que ambos participantes se benefician. A diferencia de las relaciones obligatorias (propiamente simbióticas) que existen en la naturaleza, las relaciones de polinización son prácticamente siempre facultativas u opcionales y muy flexibles: la desaparición de un polinizador o planta no acarrea necesariamente la extinción del otro participante en la interacción, ya que cada uno de ellos posee alternativas (otras fuentes de alimento en el caso del animal, u otras especies de polinizadores en el caso de la planta). Existen algunos casos sumamente interesantes de relaciones simbióticas entre un polinizador y una especie de plantas, tales como la avispa de los higos y la polilla de la yuca.
Autoincompatibilidad[editar]

La autoincompatibilidad (AI) es la incapacidad de una planta hermafrodita para producir semillas por autopolinización aunque presente gametos viables. Es una estrategia reproductiva para promover la fecundación entre individuos que no estén relacionados y, por ende, es un mecanismo creador de nueva variabilidad genética.[7]
Durante la evolución de las angiospermas la AI ha surgido en varias ocasiones, en linajes totalmente diferentes. Más de 100 familias botánicas, entre las cuales se incluyen las solanáceas, poáceas, asteráceas, brasicáceas, rosáceas y fabáceas, presentan especies autoincompatibles. De hecho, se ha estimado que el 39% de las especies de angiospermas son AI.[8] Tan amplia distribución taxonómica es congruente con la existencia de varios mecanismos genéticos diferentes que regulan la AI, dependiendo de la familia considerada.
No obstante, en todos los casos se observa un mismo fenómeno: los granos de polen que llegan al estigma de la misma planta (o de plantas genéticamente relacionadas) son incapaces de efectuar la fecundación ya que detienen su desarrollo en alguna de las etapas del proceso (germinación de los granos de polen, desarrollo de los tubos polínicos en los pistilos o fertilización de la oósfera). Como consecuencia de este impedimento no se producen semillas tras la autopolinización.[7] Esta detención del crecimiento o desarrollo de los tubos polínicos dentro de los pistilos involucra, por un lado, el reconocimiento por parte del pistilo de cuáles son los tubos polínicos del mismo individuo y cuales son los de otras plantas. Por otro lado, tras ocurrir este reconocimiento, el desarrollo de los tubos polínicos propios (o de plantas genéticamente relacionadas) debe ser interrumpido. Ambos fenómenos, el reconocimiento y la interrupción del crecimiento, han sido estudiados extensivamente tanto a nivel citológico, fisiológico, genético y molecular.[9][10]
Como se expresó previamente, los sistemas de AI en las plantas superiores han evolucionado varias veces en linajes independientes. A nivel molecular existen tres sistemas adecuadamente caracterizados: el sistema de autoincompatibilidad de las solanáceas y rosáceas; el de la amapola (Papaver) y el de Brassica. En dos de tales sistemas, se conocen en la actualidad los genes que codifican los componentes de reconocimiento polen-pistilo lo que ha demostrado claramente que las proteínas del pistilo y del polen involucradas en el reconocimiento son distintas entre sí y que la AI es un mecanismo de "llave-cerradura" a nivel molecular.[11][9]
Hercogamia[editar]
La hercogamia es un término que designa a la separación espacial de las anteras y estigmas de la misma flor, lo que reduce —o directamente impide— la autopolinización y la autogamia. En otras palabras, la hercogamia es un mecanismo que promueve el cruzamiento entre distintas plantas y, por ende, la alogamia en las angiospermas.[12] El adjetivo «hercógama» alude a la flor, planta o especie que presenta la condición de hercogamia. Según la posición relativa de las anteras y los estigmas, se reconocen distintos tipos de hercogamia:[13]
Dioecia[editar]
La androesterilidad es la condición por la cual las plantas hermafroditas o bisexuales son incapaces de producir anteras, polen o gametos masculinos funcionales.[7][14] Virtualmente, todas las especies de plantas, domesticadas y silvestres, han mostrado individuos androestériles y esa condición es heredable. La androesterilidad aparece en las plantas esporádicamente tanto en especies alógamas como en autógamas, como consecuencia de genes mutantes (generalmente recesivos), factores citoplásmicos o por un efecto combinados de ambos. La androesterilidad puede manifestarse como aborto del polen, que las anteras no abran para liberar los granos de polen que se hallan en su interior, el aborto de las anteras, que las anteras se transformen en pistilos (anteras pistiloides), entre otros muchos casos. La androesterilidad es muy útil e interesante para el mejoramiento de plantas, porque proporciona un medio muy eficaz para simplificar la formación de híbridos, y elimina así el proceso tan laborioso de la emasculación manual. En las líneas androestériles las flores no producen anteras funcionales y, por lo tanto, no puede haber autopolinización; serán polinizadas solamente por la línea o líneas que se usen como progenitor masculino.[15]
Autogamia[editar]
La autogamia es el modo de reproducción sexual consistente en la fusión de gametos femeninos y masculinos producidos por el mismo individuo. La polinización con el polen producido por la misma flor o la misma planta es una condición necesaria pero no suficiente para que se produzca autogamia, ya que el polen debe ser capaz de germinar en el estigma, crecer en el estilo y efectuar la doble fecundación. La autogamia está muy difundida entre las malezas, las plantas pioneras y las especies insulares, que necesitan que los individuos aislados fructifiquen y produzcan semillas.[16] En las especies autógamas, las flores con frecuencia son pequeñas, con piezas florales inconspicuas, producen escasa cantidad de polen y no presentan fragancia ni néctar.[17] Desde el punto de vista genético, una planta autógama obligada será homocigótica para la mayor parte de sus genes, esto es, presentará los mismos alelos en cada locus. Los descendientes de tal planta serán genéticamente iguales entre sí y con respecto a la planta original. La principal ventaja adaptativa de este modo de reproducción, entonces, es que permite la multiplicación de individuos altamente adaptados a un nicho ecológico particular. Su desventaja es que las poblaciones constituidas por un único genotipo presentan menor plasticidad adaptativa; esto es, una capacidad reducida de hacer frente a los cambios del medio ambiente.[16] Por las razones apuntadas, la mayoría de las especies autógamas son facultativas, es decir, son preponderantemente autógamas pero tienen la capacidad de producir semillas por polinización con otros individuos no emparentados. En otras palabras, la autogamia en estas especies coexiste con la alogamia en un equilibrio adaptativo.[17] La autogamia logra su mayor ventaja selectiva en aquellas especies que son pioneras, insulares o malezas. En estos casos, las poblaciones deben establecerse a partir de un único individuo aislado de cualquier otro individuo de la misma especie. Si el individuo pionero perteneciera a una especie alógama no podría dejar descendientes ya que no existe posibilidad de que pueda cruzarse con un individuo de la misma especie. Si, en cambio, tal individuo fuera autógamo, podría producir descendientes y permitor que una población de su especie se establezca en un nuevo lugar o nicho ecológico.[17] La transición desde la alogamia a la autogamia es una de las tendencias evolutivas más comunes en las plantas.[18] Como se describió previamente, esto se debe a que la autogamia permite la producción de semillas cuando los polinizadores y/o los compañeros reproductivos potenciales son escasos. Esta explicación, denominada «hipótesis del aseguramiento reproductivo», es la más antigua y más ampliamente aceptada para la evolución de la autogamia.[19][20][21] No obstante, los beneficios de la alogamia pueden reducirse o anularse en especies con fuerte depresión endogámica. O sea, si los óvulos que se habrían podido usar para ser fecundados por otra planta son autofecundados, la descendencia tendrá menor eficacia biológica.[22] Los rasgos o modificaciones de la morfología floral o del desarrollo que reducen la pérdida potencial de óvulos por autofecundación pero que, al mismo tiempo, permiten la reproducción de la planta, son favorecidos por la selección natural. Los mecanismos de retraso de la autofecundación son variados. La protoginia, por ejemplo, describe la condición en la que los estigmas se hallan receptivos antes de producirse la apertura de las anteras de la misma flor. El intervalo de tiempo hasta que se produce la dehiscencia de las anteras permite las fecundaciones con otras plantas de la misma especie. Si no hubiese fecundación cruzada, la producción de semillas queda asegurada por la autofecundación, una vez que las anteras liberan el polen de la misma flor.[23] 2
Reproducción asexual[editar]
Hongos[editar]

La multiplicación asexual de los hongos se verifica a través de diversos tipos de esporas. En los hongos acuáticos se producen zoosporas flageladas, desnudas, en general de simetría radiada. En los hongos terrestres las esporas se hallan revestidas por una pared celular. Tales esporas asexuales suelen ser resistentes a la sequedad y a la radiación, pero no especialmente al calor, por lo cual no tienen período de latencia. Pueden germinar cuando hay humedad, incluso en ausencia de nutrientes. Las esporas asexuales pueden generarse de forma interna, redondeándose la célula del interior de la hifa y quedando rodeada por una gruesa pared para luego desprenderse («clamidiosporas») o bien formándose en el interior de una estructura denominada esporangio que al madurar se rompe liberando las esporas (“esporangiosporas”). También pueden generarse de forma externa, como una producción de la hifa en vez de como una transformación («conidiosporas») y suelen formarse en estructuras diferenciadas de la hifa («conidióforos»). La variedad de las estructuras productoras de conidios es inmensa y se utilizan como característica fundamental en la clasificación de estos organismos.
Musgos[editar]
La reproducción asexual se realiza mediante fragmentación del gametófito, por gemación del protonema o a partir de los propágulos.
Helechos[editar]
las esporas (lapliodes)al caer en un lugar apropiado desarrollan una estructura laminar de tamaño pequeño.
Angiospermas[editar]
Artificial[editar]
- Acodo: Es un procedimiento por el cual se forman nuevos ejemplares partiendo de una rama de una planta madre, separándola recién al final del proceso, cuando al nuevo ejemplar ya le han brotado raíces.
- Estaca: fragmentos de rama, unos herbáceos y los otros leñosos, conteniendo alguna yema.
- Injerto: de púa, yema o aproximación: porciones de rama con una o más yemas que aplicadas sobre un patrón se sueldan con él y desarrollan el ramaje de la nueva planta.
- Esqueje.
- Técnicas de micropropagación: mediante pequeños fragmentos de la planta madre o embriones cultivados en tubos de ensayo, con solución nutritiva y ambiente aséptico.
- Cultivo de tejidos vegetales.
Natural[editar]
- Mediante las mitosporas; forma típica en hongos, musgos, helechos y líquenes
- Mediante propágulos:
Mediante semillas[editar]
Apomixis[editar]
Las plantas que presentan este tipo de reproducción (las que se denominan plantas apomícticas) producen sus semillas sin que ocurra meiosis ni fertilización, por lo que sus descendientes son genéticamente idénticos a la planta madre.[24] Aunque desde el punto de vista evolutivo las plantas apomícticas carecen de las ventajas adaptativas que ofrece la reproducción sexual, la apomixis permite la fijación indefinida de genotipos altamente adaptados a su ambiente. Esta ventaja de la apomixis es -desde el punto de vista genético- la misma que presenta la multiplicación vegetativa. No obstante, en el caso de las plantas apomícticas los descendientes no permanecen en las inmediaciones de la planta madre, compitiendo con ella por recursos, sino que gracias a la dispersión de las semillas los nuevos individuos pueden explorar y conquistar nuevos ambientes.[25][26] La apomixis se halla ampliamente distribuida en ciertas familias de plantas, tales como las poáceas, las rosáceas y las compuestas. En estas últimas la apomixis es un tipo de reproducción obligada en muchas especies, mientras que en las otras dos familias la apomixis y la reproducción sexual pueden tener lugar, lado a lado, en el mismo individuo (apomixis facultativa).[27]
La apomixis elude la ruta sexual evitando la reducción meiótica y la fecundación. El óvulo desarrolla una semilla cuyo embrión contiene exactamente el mismo genotipo que la planta que lo origina. Los embriones apomícticos pueden formarse a través de una ruta esporofítica o gametofítica. En la primera, también llamada embrionía adventicia, los embriones surgen directamente de una célula somática de la nucela o de los tegumentos del óvulo. Esta forma de apomixis aparece comúnmente en los cítricos, los cuales se convirtieron en un sistema modelo para estudiar el proceso. En la apomixis gametofítica se forman siempre sacos embrionarios que difieren en algunos aspectos del gametófito femenino haploide (n) generado a partir de la megáspora funcional. Su principal diferencia es precisamente el hecho de ser diploides (2n) ya que los núcleos que los conforman no han pasado por el proceso meiótico y por lo tanto no han reducido su número cromosómico. Por eso se dice que estos sacos embrionarios surgen por un proceso de apomeiosis ("sin meiosis"). De acuerdo con el origen de la célula que genera al saco embrionario y al embrión, la apomixis gametofítica puede ser clasificada como: diplosporía, cuando el saco embrionario se origina a partir de la célula madre de la megáspora misma ya sea por mitosis o luego de una falla en la meiosis o aposporía, cuando el saco embrionario se origina directamente por mitosis a partir de una célula somática, usualmente una célula de la nucela.[24]
Los sacos embrionarios, sean estos apospóricos o diplospóricos, contienen un gameto femenino diploide (2n), la ovocélula, a partir de la cual se desarrolla directamente el embrión por partenogénesis sin que exista fecundación. Así, mientras en el proceso sexual la reducción meiótica se complementa con la fecundación que restaura el nivel de ploidía 2n, en la apomixis gametofítica la ausencia de reducción se complementa con la partenogénesis.[28] En la apomixis gametofítica la partenogénesis excluye uno de los procesos de la doble fecundación: la unión de los gametos masculinos con los femeninos. Sin embargo no necesariamente se anula la fecundación de los núcleos polares. Aunque en algunos casos el endosperma puede desarrollarse en forma autónoma (sin la unión de un gameto masculino con los núcleos polares del saco embrionario apospórico o diplospórico) en muchas especies apomícticas, como ocurre en la mayoría de las gramíneas tropicales, es necesario que un gameto masculino se fusione con el o los núcleos polares de la célula central del saco embrionario para formar el endospermo. A este proceso se lo llama pseudogamia.[28][29][30][31][32][33]
Por lo expuesto, existen tres tipos diferentes de mecanismos de apomixis:[24][28]
- Diplosporia: la célula madre del saco embrionario o gametófito femenino se desarrolla directamente en un embrión, proceso conocido con el nombre de partenogénesis diploide. El embrión es diploide.
- Aposporia: el saco embrionario tiene su origen en una célula somática de las múltiples que rodean la célula madre del saco embrionario (nucela). El embrión es diploide.
En ambos casos se desarrolla un gametófito pero la meiosis no existe o, en el caso de que se produzca, no tiene consecuencias observables. Por esta razón se llama también a este fenómeno apomixis gametofítica.
- Embrionía adventicia: no se desarrolla saco embrionario. El embrión se desarrolla a partir de células del esporófito diploide (ejemplo, integumento).
Referencias[editar]
- ↑ C.J. Alexopolous, C. W. Mims, M. Blackwell, Introductory Mycology, 4th ed. (John Wiley and Sons, Hoboken NJ, 2004) ISBN 0-471-52229-5
- ↑ Casselton LA (2002). «Mate recognition in fungi». Heredity 88 (2): 142-147. PMID 11932772. doi:10.1038/sj.hdy.6800035.
- ↑ Buck, William R. & Bernard Goffinet. (2000). "Morphology and classification of mosses", pages 71-123 in A. Jonathan Shaw & Bernard Goffinet (Eds.), Bryophyte Biology. (Cambridge: Cambridge University Press). ISBN 0-521-66097-1.
- ↑ Frahm, J.P. Biologie der Moose. Spektrum Akademischer Verlag, Heidelberg und Berlin 2001, ISBN 3-8274-0164-X
- ↑ [1] Polinización de cultivos. Escrito por Adolfo Francisco Muñoz Rodríguez (books.google.es)
- ↑ [2] Polinización de cultivos. Escrito por Adolfo Francisco Muñoz Rodríguez. (books.google.es)
- ↑ a b c Frankel, R. & Galun, E. (1977). Pollination mechanisms, reproduction, and plant breeding. Monographs on Theoretical and Applied Genetics no. 2. Springer-Verlag. Berlín. ISBN 0387079343.
- ↑ Igic, B., Russell Lande, & Joshua R. Kohn, (2008). «Loss of Self-Incompatibility and Its Evolutionary Consequences». Int. J. Plant Sci. 169 (1): 93-104.
- ↑ a b Franklin-Tong, Veronica E. (Ed.) (2008). Self-Incompatibility in Flowering Plants. Evolution, Diversity, and Mechanisms. Springer-Verlag. Berlín. ISBN 978-3-540-68485-5.
- ↑ Boavida LC, Vieira AM, Becker JD, Feijó JA. (2005). «Gametophyte interaction and sexual reproduction: how plants make a zygote». Int. J. Dev. Biol. 49: 615-632. doi: 10.1387/ijdb.052023lb.
- ↑ Deborah Charlesworth, Xavier Vekemans, Vincent Castric, Sylvain Glémin. 2005. Plant self-incompatibility systems: a molecular evolutionary perspective New Phytologist 168 (1) , 61–69 doi:10.1111/j.1469-8137.2005.01443.x.
- ↑ Pinar, S. 2009. Introducción al libro Las distintas formas de las flores en plantas de la misma especie de Charles Darwin. Biblioteca Darwiniana. Academia Mexicana de Ciencias. 283 p. ISBN 9788400087968.
- ↑ Peter K. Endress (1996). Diversity and evolutionary biology of tropical flowers Cambridge tropical biology series. Cambridge University Press. pp. 194-195. ISBN 9780521565103. Consultado el 3 de febrero de 2013.
- ↑ Hartmann, H.T. (Ed.) 1997. Propagación de Plantas: Principios y Prácticas. Prentice Hall NJ., Estados Unidos
- ↑ Howell, S.H. 1998. Genética de Plantas y su desarrollo. Cambridge Univ. Press. MA., Estados Unidos.
- ↑ a b González, A.M. «Polinización». Morfología de Plantas Vasculares. Argentina: Universidad Nacional del Nordeste. Archivado desde el original el 9 de agosto de 2014. Consultado el 10 de enero de 2013.
- ↑ a b c Frankel, R. & Galun, E. Pollination mechanisms, reproduction, and plant breeding. Monographs on Theoretical and Applied Genetics no. 2. Springer-Verlag. Berlin. 1977. 281 p.
- ↑ Stebbins, G. L.1974. Flowering Plants: Evolution above the Species Level. Belknap, Cambridge, Massachusetts.
- ↑ Darwin, C. R. 1876. The Effects of Cross and Self-fertilization in the Vegetable Kingdom. John Murray, London.
- ↑ Baker, H. G. 1955. Self-compatibility and establishment after `long-distance' dispersal. Evolution 9, 347±348.
- ↑ Jain, S. K. 1976. The evolution of inbreeding in plants. Annu. Rev. Ecol. Syst. 7, 69-95
- ↑ Lloyd, D. G. 1992. Self- and cross-fertilization in plants. II. The selection of self-fertilization. Int. J. Plant Sci. 153, 370-380.
- ↑ Schoen, D. J., Morgan, M. T. & Bataillon, T. 1996. How does self-pollination evolve? Inferences from floral ecology and molecular genetic variation. Phil. Trans. R. Soc. Lond. B 351, 1281-1290.
- ↑ a b c Richards, A.J. (2003), «Apomixis in flowering plants: an overview», Philosophical Transactions of the Royal Society B: Biological Sciences 358 (1434): 1085-1093, doi:10.1098/rstb.2003.1294. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Sven E. Asker, Lenn Jerling: Apomixis in Plants. CRC Press, Boca Raton 1992, S. 50f. ISBN 0-8493-4545-6
- ↑ Whitton, J.; Sears, C.J.; Baack, E.J.; Otto, S.P. (2008), «The Dynamic Nature of Apomixis in the Angiosperms», International Journal of Plant Sciences 169 (1): 169, doi:10.1086/523369.
- ↑ Universidad de Hamburgo (2001 en adelante). «Types of Propagation. Systems of Recombination». Botanic on line (en inglés). Archivado desde el original el 13 de mayo de 2008. Consultado el 28 de abril de 2008.
- ↑ a b c Nogler, G.A. (1984a). Gametophytic apomixis. In: Embryology of Angiosperms, B.M. Johri, ed (Berlin: Springer-Verlag), pp. 475–518.
- ↑ Gustaffson, A., 1947. Apomixis in higher plants. III. Biotype and species formation. Lunds, Univ. Arsskr., 44, 183-370.
- ↑ Knox. R. B. 1967. Apomixis. Seasonal and population differences in a grass. Science, 157,325—326.
- ↑ Stebbins, G. L. 1941. Apomixis in the angiosperms. Bot Rev., 10, 507-542.
- ↑ Grant, V. 1971. Plant Speciation, 435 pp. Columbia University Press, New York.
- ↑ de Wet, J. M., & Stalker, H. T. 1974. Gametophytic apomixis and evolution in plants. Taxon, 23, 689-697.
